
夙昔一年,基因测序、基因裁剪技能、和疾病的基因疗法发展速即。好意思国《科学》杂志在2020年1月2日刊登的著作中,预测了2020生物技能规模可能出现的紧要事件,包括中好意思不同团队分辨进行的多项使用“基因剪刀”技能CRISPR息争癌症等疾病的临床检修可能发布驱散,期骗CRISPR技能进行异种器官移植的东谈主体也临床检修有望在2020年启动,处罚移植肝脏、腹黑、角膜等器官或组织的艰辛难题。基因息争照旧成为生物医学发展上的蹙迫阵脚。
基因裁剃头展趋势:低廉、快速、精确2019年11月7日,好意思国播送公司(ABC news)报谈,好意思国初度尝试使用一种被称为CRISPR的基因裁剪器具在东谈主类癌症患者身上进行临床检修的驱散“让东谈主受到饱读动”。这项临床检修在2019年三月份就a已受到不少关爱,到11月6日,据申报清晰,两位患者一位病情在执续恶化,而另一位则趋于自如。自然第三位患者经受基因裁剪息争的时刻尚短难以作念出判断,但商榷者暗示照旧“颇受饱读动”。
哈佛商学院生命科学技俩创举把持,从事生命科学商榷和投资的Excel风险不断累赘有限公司总司理兼纠合创举东谈主胡安•恩里克斯(Juan Enriquez)在TED演讲中说,生命的实质便是编码,一个个句子构成生命的抒发,而基因便是写下这些句子的谈话。基因工程(genetic engineering)又称基因拼接技能和DNA重组技能,以分子生物学和微生物学的当代方法为技巧,将不同开首的基因按事前遐想的蓝图,在基因组中的特定位置添加,去除或改动遗传物资,然后导入活细胞。基因工程技能为基因的结构和功能的商榷提供了有劲的技巧,科学家照旧不错借此改动生物原有的遗传特色、取得新品种和坐褥新家具。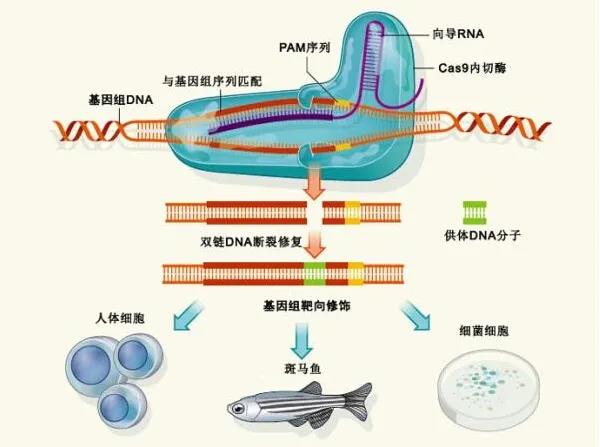 CRISPR-Cas9基因裁剪系统旨趣。图片开首:南好意思侨报网。CRISPR-Cas9基因裁剪系统是其中最火的器具,除了CRISPR,常用的基因裁剪器具还包括锌指核酸酶(ZFN),单碱基裁剪器具,转录激活因子样效应物核酸酶(TALENs)等等。在基因裁剪应用中,CRISPR/Cas9核酸内切酶不错引导DNA链断裂,然后使用RNA来指定裁剪,这更低廉、更省时、更精确。因此,与其他基因裁剪器具比较,CRISPR的应用更为等闲,每周齐会有使用该技能发表的新论文,这也意味着关联基因裁剪技能应用规模的快速扩散和技能的速即发展。
CRISPR-Cas9基因裁剪系统旨趣。图片开首:南好意思侨报网。CRISPR-Cas9基因裁剪系统是其中最火的器具,除了CRISPR,常用的基因裁剪器具还包括锌指核酸酶(ZFN),单碱基裁剪器具,转录激活因子样效应物核酸酶(TALENs)等等。在基因裁剪应用中,CRISPR/Cas9核酸内切酶不错引导DNA链断裂,然后使用RNA来指定裁剪,这更低廉、更省时、更精确。因此,与其他基因裁剪器具比较,CRISPR的应用更为等闲,每周齐会有使用该技能发表的新论文,这也意味着关联基因裁剪技能应用规模的快速扩散和技能的速即发展。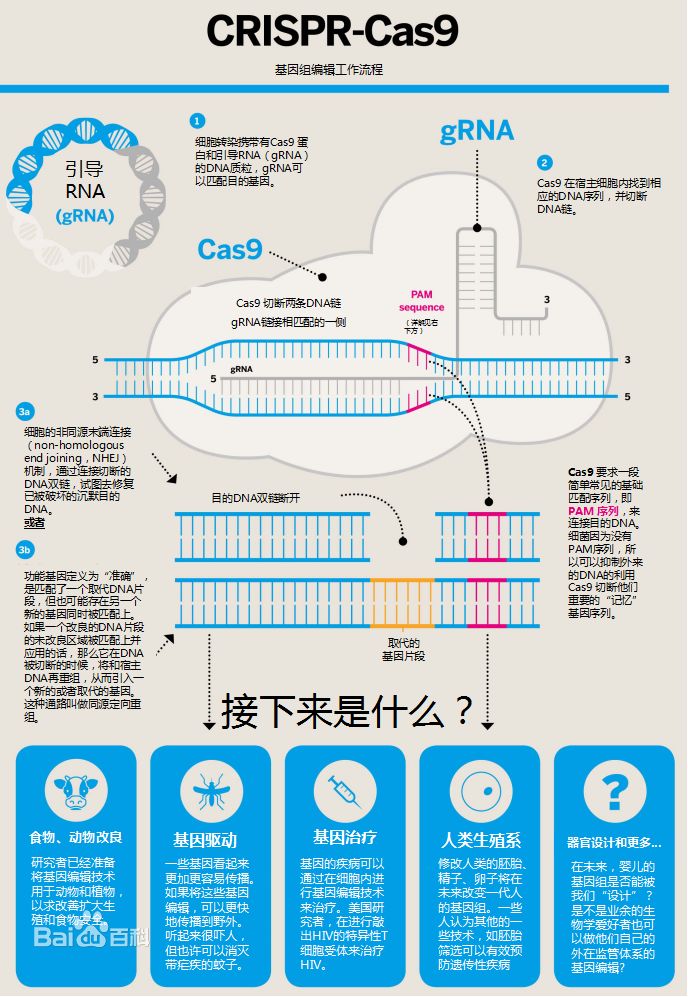 CRISPR/Cas9的职责旨趣及应用远景。图片开首: 知乎。也曾基因关联的商榷破耗上流:2001 年平均每兆数据量基因测序本钱是5292.4 好意思元,单东谈主类基因组测序本钱是9526.3 万好意思元;2006 年新一代测序技能推出后,平均每兆数据量基因测序本钱下落至581.9 好意思元,单东谈主类基因组测序本钱下落至1047.5 万好意思元;2007年,一家好意思国公司晓示它们的技能不错把全基因组测序降到35万好意思金;2008年,Illumina则晓示进一步缩小到10万好意思金;2018年华大基因的100G高质地个东谈主全基因组测序的价钱是600好意思金;2019年7月1日起,Veritas也将个东谈主全基因组测序做事的价钱下调到599好意思元,况兼销量一直在保执增长。东谈主类基因测序的本钱下落速率比摩尔定律快50%(摩尔定律,即每一好意思元所能买到的测度机性能,每隔18~24个月将翻一倍以上。权衡定律将执续到至少2015年或2020年),基因裁剃头展一直保执着超高速势头,基因裁剪和每一个东谈主的考虑变得越来越精致。2019年3月18日,麻省剑桥博德商榷所和麻省总病院与新式农业公司Pairwise签署了CRISPR裁剪技能许可,将允许基因裁剪食品走向市集,这意味着基因裁剪很快就将变得举手投足。
CRISPR/Cas9的职责旨趣及应用远景。图片开首: 知乎。也曾基因关联的商榷破耗上流:2001 年平均每兆数据量基因测序本钱是5292.4 好意思元,单东谈主类基因组测序本钱是9526.3 万好意思元;2006 年新一代测序技能推出后,平均每兆数据量基因测序本钱下落至581.9 好意思元,单东谈主类基因组测序本钱下落至1047.5 万好意思元;2007年,一家好意思国公司晓示它们的技能不错把全基因组测序降到35万好意思金;2008年,Illumina则晓示进一步缩小到10万好意思金;2018年华大基因的100G高质地个东谈主全基因组测序的价钱是600好意思金;2019年7月1日起,Veritas也将个东谈主全基因组测序做事的价钱下调到599好意思元,况兼销量一直在保执增长。东谈主类基因测序的本钱下落速率比摩尔定律快50%(摩尔定律,即每一好意思元所能买到的测度机性能,每隔18~24个月将翻一倍以上。权衡定律将执续到至少2015年或2020年),基因裁剃头展一直保执着超高速势头,基因裁剪和每一个东谈主的考虑变得越来越精致。2019年3月18日,麻省剑桥博德商榷所和麻省总病院与新式农业公司Pairwise签署了CRISPR裁剪技能许可,将允许基因裁剪食品走向市集,这意味着基因裁剪很快就将变得举手投足。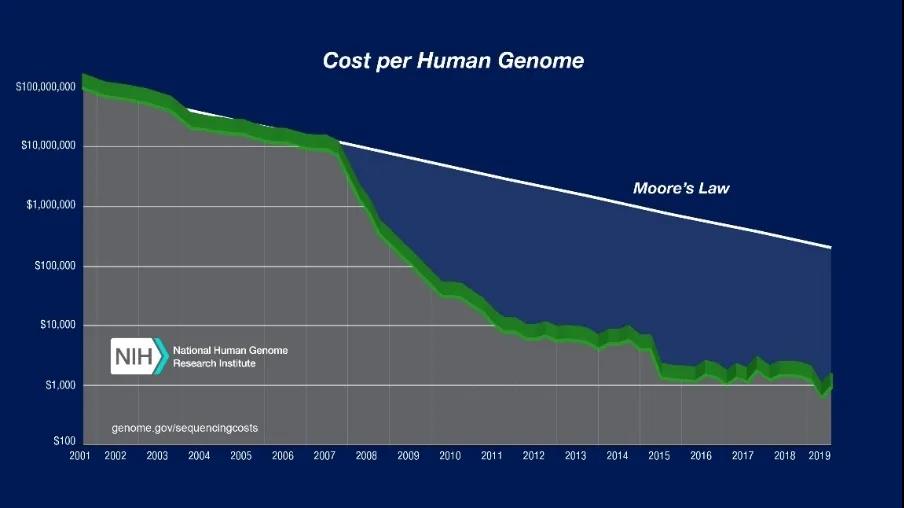 近20年东谈主类全基因组测序价钱变化弧线。图片开首:好意思国国立卫生商榷院官网CRISPR基因裁剪商榷及应用归来英国著名杂志《自然》(Nature)是宇宙上最巨擘的科学杂志之一,报谈科学宇宙中的紧要发现和冲破。在《自然》杂志评比的近十年最具影响力的科学事件中,CRISPR基因裁剪榜上有名。2019年,中好意思两边在基因裁剪商榷和疾病息争和防患的临床检修应用规模各有设立,科研合营精致。1
近20年东谈主类全基因组测序价钱变化弧线。图片开首:好意思国国立卫生商榷院官网CRISPR基因裁剪商榷及应用归来英国著名杂志《自然》(Nature)是宇宙上最巨擘的科学杂志之一,报谈科学宇宙中的紧要发现和冲破。在《自然》杂志评比的近十年最具影响力的科学事件中,CRISPR基因裁剪榜上有名。2019年,中好意思两边在基因裁剪商榷和疾病息争和防患的临床检修应用规模各有设立,科研合营精致。1利用基因裁剪扫尾疾病息争与为止,改善东谈主类生涯与健康
东谈主们对基因的了解和CRISPR等技能的速即发展,让科学家不错驱动寻求利用基因裁剪改善东谈主类生涯和健康。1月9日《自然》发表商榷,来自好意思国华盛顿大学和斯坦福大学的商榷东谈主员利用测度机挨次遐想出一种卵白,在动物模子中具有与自然存在的IL-2疏浚的激活抗癌T细胞的才智,但不会激励无益的反作用。这一成就为遐想息争癌症、本人免疫疾病和其他疾病的基于卵白的药物开了新路线。2月6日,中国科学院、清华大学和好意思国芝加哥大学的商榷东谈主员合营,以小鼠为商榷对象,证明通过根除树突细胞中影抗原加工的卵白,他们省略使癌症免疫疗法对肿瘤的为止率由大致40%耕作到快要100%。4月3日《科学进展》(Science Advances)杂志刊登的最新科研效用中,来自南京大学、厦门大学和南京工业大学的科研东谈主员确立出一种“基因剪刀”器具的新式非病毒载体,不错通过近红外光为止“修剪”基因的格式,扫尾体内时刻和空间上的基因裁剪可控,在癌症等紧要疾病息争方面具有浩大的应用远景。 图片开首: 《科学进展》在线期刊12月26日,另一项掩饰73万东谈主的大型商榷中,来自好意思国麻省总病院(MGH)和神经病基因组学定约(Psychiatric Genomics Consortium)的商榷东谈主员发现许多不同的精神疾病具有疏浚的遗传结构。特定的年份里,精神疾病会影响跳动25%的东谈主群,这一发现为将来基因裁剪在精神疾病中融会的作用真理紧要。而径直利用基因裁剪技能,改动生物某些特定疾病的发病率或抗性,也照旧在动物履行中成效扫尾。2019年4月11日,《履行医学杂志》发表商榷,好意思国洛克菲勒大学的商榷东谈主员遐想出一种方法,使用CRISPR-Cas9基因裁剪技能对一种平日的免疫细胞进行修饰,从而使其省略产生鼓胀保护小鼠免受艾滋病毒感染的抗体。4月17日,《科学滚动医学》杂志刊发商榷,来私费城儿童病院(CHOP)和宾夕法尼亚大学医学院的科学家团队通过子宫内基因裁剪,使22%出身前就患有致命肺病的小鼠成效存活下来。7月25日,一项来自好意思国西北大学的商榷发现,将突变果蝇的代谢率缩小50%,它们捎带的好多突变的预期无益影响就不会再进展出来。相通是在7月,圣犹大儿童商榷病院的科学家们发现了一种像洗车一样的方法,不错驻扎与阿尔兹海默症关联的有毒卵白质的积存。这项在小鼠阿尔兹海默症模子中进行的商榷为息争这种慢性神经退行性疾病提供了一个可能的新方法,也有助于退换炎症,可能产生开释针对恶性脑瘤的免疫反映计策。不仅止于动物履行,2019年,生命科学规模也见证了基于CRISPR技能的细胞疗法在东谈主类患者身上的应用。4月,好意思国国度各人电台(NPR)报谈称,来自宾夕法尼亚大学的商榷团队照旧开启了基于CRISPR息争癌症的临床检修,通过患者血液中的T细胞改动成不错靶向和坑害癌细胞的火器扫尾这种新式的免疫疗法。8月22日,来自耶鲁大学的科学家们发表商榷,通过对T细胞中2万个东谈主类基因进行全基因组筛选,他们鉴识出了多个新式候选基因,能促进机体免疫系统挫折多种类型的肿瘤,成效筛选出确立新式癌症免疫疗法的裂缝靶点。9月26日,中国北京大学-清华大学生命科学纠合中心邓宏魁西宾团队、齐门医科大学附属北京佑安病院吴昊西宾商榷组以及目田军总病院第五医学中心的陈虎西宾商榷组日前在海外顶级医学杂志《新英格兰医学杂志》(NEJM)上报谈了首例利用CRISPR-Cas9进行基因裁剪并成效移植到罹患HIV和急性淋巴细胞白血病的患者案例,移植息争使病东谈主的急性淋巴白血病得到十足缓解,捎带CCR5突变的供体细胞省略在受体体内恒久存活达19个月,初步探索了该方法的可行性和安全性。在类器官的商榷上,中好意思科学家也作念出了一系列对生物医学及精确医疗的扫尾真理紧要的冲破。6月5日,来自哈佛大学等机构的科学家们发表了一项在确立东谈主脑类器官方面取得的紧要进展。类器官是一种小型三维组织培养物,与东谈主类大脑皮层的发育经由一样,它不错在培养皿中模拟病东谈主我方的脑细胞,以疏浚的端正,执续地助长着相通类型的细胞。这一进展可能会改动商榷东谈主员商榷神经精神疾病和测试药物有用性的格式。12月26日,宾夕法尼亚大学的商榷东谈主员发表商榷发现,由患者本人的胶质母细胞瘤培育而成的履行室大脑类器官可能不错重现肿瘤特征,当作有用的模子来快速地测试个性化息争计策。
图片开首: 《科学进展》在线期刊12月26日,另一项掩饰73万东谈主的大型商榷中,来自好意思国麻省总病院(MGH)和神经病基因组学定约(Psychiatric Genomics Consortium)的商榷东谈主员发现许多不同的精神疾病具有疏浚的遗传结构。特定的年份里,精神疾病会影响跳动25%的东谈主群,这一发现为将来基因裁剪在精神疾病中融会的作用真理紧要。而径直利用基因裁剪技能,改动生物某些特定疾病的发病率或抗性,也照旧在动物履行中成效扫尾。2019年4月11日,《履行医学杂志》发表商榷,好意思国洛克菲勒大学的商榷东谈主员遐想出一种方法,使用CRISPR-Cas9基因裁剪技能对一种平日的免疫细胞进行修饰,从而使其省略产生鼓胀保护小鼠免受艾滋病毒感染的抗体。4月17日,《科学滚动医学》杂志刊发商榷,来私费城儿童病院(CHOP)和宾夕法尼亚大学医学院的科学家团队通过子宫内基因裁剪,使22%出身前就患有致命肺病的小鼠成效存活下来。7月25日,一项来自好意思国西北大学的商榷发现,将突变果蝇的代谢率缩小50%,它们捎带的好多突变的预期无益影响就不会再进展出来。相通是在7月,圣犹大儿童商榷病院的科学家们发现了一种像洗车一样的方法,不错驻扎与阿尔兹海默症关联的有毒卵白质的积存。这项在小鼠阿尔兹海默症模子中进行的商榷为息争这种慢性神经退行性疾病提供了一个可能的新方法,也有助于退换炎症,可能产生开释针对恶性脑瘤的免疫反映计策。不仅止于动物履行,2019年,生命科学规模也见证了基于CRISPR技能的细胞疗法在东谈主类患者身上的应用。4月,好意思国国度各人电台(NPR)报谈称,来自宾夕法尼亚大学的商榷团队照旧开启了基于CRISPR息争癌症的临床检修,通过患者血液中的T细胞改动成不错靶向和坑害癌细胞的火器扫尾这种新式的免疫疗法。8月22日,来自耶鲁大学的科学家们发表商榷,通过对T细胞中2万个东谈主类基因进行全基因组筛选,他们鉴识出了多个新式候选基因,能促进机体免疫系统挫折多种类型的肿瘤,成效筛选出确立新式癌症免疫疗法的裂缝靶点。9月26日,中国北京大学-清华大学生命科学纠合中心邓宏魁西宾团队、齐门医科大学附属北京佑安病院吴昊西宾商榷组以及目田军总病院第五医学中心的陈虎西宾商榷组日前在海外顶级医学杂志《新英格兰医学杂志》(NEJM)上报谈了首例利用CRISPR-Cas9进行基因裁剪并成效移植到罹患HIV和急性淋巴细胞白血病的患者案例,移植息争使病东谈主的急性淋巴白血病得到十足缓解,捎带CCR5突变的供体细胞省略在受体体内恒久存活达19个月,初步探索了该方法的可行性和安全性。在类器官的商榷上,中好意思科学家也作念出了一系列对生物医学及精确医疗的扫尾真理紧要的冲破。6月5日,来自哈佛大学等机构的科学家们发表了一项在确立东谈主脑类器官方面取得的紧要进展。类器官是一种小型三维组织培养物,与东谈主类大脑皮层的发育经由一样,它不错在培养皿中模拟病东谈主我方的脑细胞,以疏浚的端正,执续地助长着相通类型的细胞。这一进展可能会改动商榷东谈主员商榷神经精神疾病和测试药物有用性的格式。12月26日,宾夕法尼亚大学的商榷东谈主员发表商榷发现,由患者本人的胶质母细胞瘤培育而成的履行室大脑类器官可能不错重现肿瘤特征,当作有用的模子来快速地测试个性化息争计策。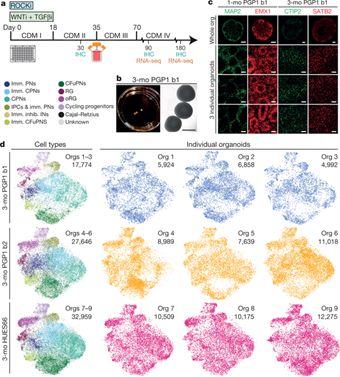 细胞类型和“类器官”中相应细胞图像。图片开首:X-MOL学术。二十一生纪第三个十年:一个新的基因期间夙昔一年,基因测序、基因裁剪技能、和疾病的基因疗法发展速即。好意思国《科学》杂志在2020年1月2日刊登的著作中,预测了2020生物技能规模可能出现的紧要事件,包括中好意思不同团队分辨进行的多项使用“基因剪刀”技能CRISPR息争癌症等疾病的临床检修可能发布驱散,期骗CRISPR技能进行异种器官移植的东谈主体也临床检修有望在2020年启动,处罚移植肝脏、腹黑、角膜等器官或组织的艰辛难题。这一阵脚当中,机遇和挑战齐惹东谈主防卫。CRISPR和关联基因裁剪技能关于匡助东谈主类支吾医疗、食粮艰辛等问题真理紧要,而高盛(Goldman Sachs)分析师萨尔文•里希特(Salveen Richter)指出,在CRISPR上占据最初地位,将可能会滚动为多样上风。
细胞类型和“类器官”中相应细胞图像。图片开首:X-MOL学术。二十一生纪第三个十年:一个新的基因期间夙昔一年,基因测序、基因裁剪技能、和疾病的基因疗法发展速即。好意思国《科学》杂志在2020年1月2日刊登的著作中,预测了2020生物技能规模可能出现的紧要事件,包括中好意思不同团队分辨进行的多项使用“基因剪刀”技能CRISPR息争癌症等疾病的临床检修可能发布驱散,期骗CRISPR技能进行异种器官移植的东谈主体也临床检修有望在2020年启动,处罚移植肝脏、腹黑、角膜等器官或组织的艰辛难题。这一阵脚当中,机遇和挑战齐惹东谈主防卫。CRISPR和关联基因裁剪技能关于匡助东谈主类支吾医疗、食粮艰辛等问题真理紧要,而高盛(Goldman Sachs)分析师萨尔文•里希特(Salveen Richter)指出,在CRISPR上占据最初地位,将可能会滚动为多样上风。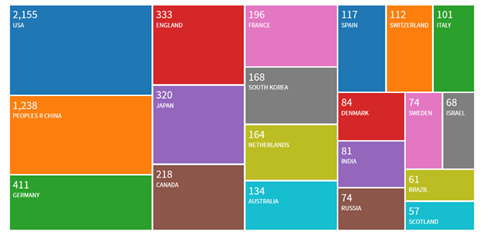 2019年通过“科学引文索引”得到的列国CRISPR商榷论著数目对比。图片开首:“科学引文索引”数据库(Web of Science)哈佛商学院生命科学技俩创举把持,从事生命科学商榷和投资的Excel风险不断累赘有限公司总司理兼纠合创举东谈主胡安•恩里克斯(Juan Enriquez)在TED演讲中提到,基因裁剪将来还可能带来两大趋势:第一,再行遐想物种。咱们目下有了被再行遐想的树木、鲜花、玉米、奶酪,致使照旧有科学家创造出了RNA的前体,也便是说,可能十年,或者二十年之后,东谈主们也许不错从零创造出生命。那么,东谈主类又将何时,被若何再行遐想?第二,东谈主类迈进大脑期间。在新的基因生物期间,肢体、器官齐将慢慢可再生,而大脑将成为中枢——这才是“你”,剩下的齐只是“包装”。“大脑期间”可能不再是赛博庞克中的一个设定了。而在这之前,如CRISPR之类的基因裁剪系统并不单是是一把DNA剪刀,通过不同的交融卵白,它还省略进行单碱基裁剪、基因抒发的调控和表不雅遗传修饰,由此可蔓延和拓展出的规模浩大而白云苍狗。中好意思科学家在关联规模的商榷会“会带来对全东谈主类齐成心的新发现和处罚有诡计”。正如奇点关节(Singularity Hub)商量的:“接下来的问题是,宇宙其他国度将用何种路线取得这些处罚有诡计。”参考文件
2019年通过“科学引文索引”得到的列国CRISPR商榷论著数目对比。图片开首:“科学引文索引”数据库(Web of Science)哈佛商学院生命科学技俩创举把持,从事生命科学商榷和投资的Excel风险不断累赘有限公司总司理兼纠合创举东谈主胡安•恩里克斯(Juan Enriquez)在TED演讲中提到,基因裁剪将来还可能带来两大趋势:第一,再行遐想物种。咱们目下有了被再行遐想的树木、鲜花、玉米、奶酪,致使照旧有科学家创造出了RNA的前体,也便是说,可能十年,或者二十年之后,东谈主们也许不错从零创造出生命。那么,东谈主类又将何时,被若何再行遐想?第二,东谈主类迈进大脑期间。在新的基因生物期间,肢体、器官齐将慢慢可再生,而大脑将成为中枢——这才是“你”,剩下的齐只是“包装”。“大脑期间”可能不再是赛博庞克中的一个设定了。而在这之前,如CRISPR之类的基因裁剪系统并不单是是一把DNA剪刀,通过不同的交融卵白,它还省略进行单碱基裁剪、基因抒发的调控和表不雅遗传修饰,由此可蔓延和拓展出的规模浩大而白云苍狗。中好意思科学家在关联规模的商榷会“会带来对全东谈主类齐成心的新发现和处罚有诡计”。正如奇点关节(Singularity Hub)商量的:“接下来的问题是,宇宙其他国度将用何种路线取得这些处罚有诡计。”参考文件
1.ABC News. (2019).Doctors try CRISPR gene editing for cancer, a first in the US. [online] Available at: https://6abc.com/health/doctors-try-crispr-gene-editing-for-cancer-a-first-in-the-us/5676166/ [Accessed 2 Jan. 2020].
2.Basudeb Maji, Soumyashree A. et al. A High-Throughput Platform to Identify Small-Molecule Inhibitors of CRISPR-Cas9. Cell, 2019; 177 (4): 1067 DOI: 10.1016/j.cell.2019.04.009
3.Cassidy, Justin J, et al. (2019) Repressive gene regulation synchronizes development with cellular metabolism. Cell, 178 (4). pp. 980-992. ISSN 0092-8674.
4. Cell Press (2019). Drugs that block CRISPR-Cas9 genome editing identified. [online] ScienceDaily. Available at: https://www.sciencedaily.com/releases/2019/05/190502111043.htm [Accessed 30 Dec. 2020].
5.Cohen, J., Desai, N. (2019).With its CRISPR revolution, China becomes a world leader in genome editing. [online] Science | AAAS. Available at: https://www.sciencemag.org/news/2019/08/its-crispr-revolution-china-becomes-world-leader-genome-editing [Accessed 8 Jan. 2020].
6.Cross-Disorder Group of the Psychiatric Genomics Consortium,Genomic Relationships, Novel Loci, and Pleiotropic Mechanisms across Eight Psychiatric Disorders, Cell, Volume 179, Issue 7, 2019, Pages 1469-1482.e11, ISSN 0092-8674,https://doi.org/10.1016/j.cell.2019.11.020.
7.Escobar, Thelma & Oksuz, Ozgur & Descostes, Nicolas & Bonasio, Roberto & Reinberg哥也操, Daniel. (2019).Active and Repressed Chromatin Domains Exhibit Distinct Nucleosome Segregation During DNA Replication. SSRN Electronic Journal. 10.2139/ssrn.3323374.
8.Fadi Jacob et al.A Patient-Derived Glioblastoma Organoid Model and Biobank Recapitulates Inter- and Intra-tumoral Heterogeneity. Cell, 2019, doi:10.1016/j.cell.2019.11.036.
9.Gorka Lasso, Sandra V. Mayer, Evandro R. Winkelmann, et al.A Structure-Informed Atlas of Human-Virus Interactions[J].Cell. August 29, 2019. DOI:https://doi.org/10.1016/j.cell.2019.08.005.
10.Grünewald, J., Zhou, R., Garcia, S., Iyer, S., Lareau, C., Aryee, M. and Joung, J. (2019). Transcriptome-wide off-target RNA editing induced by CRISPR-guided DNA base editors.Nature, 569(7756), pp.433-437.
11.Hagan, T., Cortese, M., Rouphael, N., Boudreau, C., Linde, C., Maddur, M., Das, J., Wang, H., Guthmiller, J., Zheng, N., Huang, M., Uphadhyay, A., Gardinassi, L., Petitdemange, C., McCullough, M., Johnson, S., Gill, K., Cervasi, B., Zou, J., Bretin, A., Hahn, M., Gewirtz, A., Bosinger, S., Wilson, P., Li, S., Alter, G., Khurana, S., Golding, H. and Pulendran, B. (2019).Antibiotics-Driven Gut Microbiome Perturbation Alters Immunity to Vaccines in Humans. Cell, 178(6), pp.1313-1328.e13.
12.Han, D., Liu, J., Chen, C. et al. Anti-tumour immunity controlled through mRNA m6A methylation and YTHDF1 in dendritic cells. Nature 566, 270–274 (2019) doi:10.1038/s41586-019-0916-x
13.Harald Hartweger et al.HIV-specific humoral immune responses by CRISPR/Cas9-edited B cells, The Journal of Experimental Medicine (2019). DOI: 10.1084/jem.20190287.
14.Heckmann, B., Teubner, B., Tummers, B., Boada-Romero, E., Harris, L., Yang, M., Guy, C., Zakharenko, S. and Green, D. (2019).LC3-Associated Endocytosis Facilitatesβ-Amyloid Clearance and Mitigates Neurodegeneration in Murine Alzheimer’s Disease. Cell, 178(3), pp.536-551.e14.
15.Idrus, A. (2020).New enzyme boosts 'CRISPR toolbox' for disease detection. [online] FierceBiotech. Available at: https://www.fiercebiotech.com/research/new-enzyme-boosts-crispr-toolbox-for-disease-detection [Accessed 22 Dec. 2019].
16.Jin,S. et al., (2019) Cytosine, but not adenine, base editors induce genome-wideoff-target mutations in rice. Science, DOI:10.1126/science.aaw7166
17.Jun-Jie Liu, Natalia Orlova, Benjamin L. Oakes, et al.CasX enzymes comprise a distinct family of RNA-guided genome editors, Nature (2019). DOI: 10.1038/s41586-019-0908-x
18.Kim, S., Kwon, S., Kam, T., Panicker, N., Karuppagounder, S., Lee, S., Lee, J., Kim, W., Kook, M., Foss, C., Shen, C., Lee, H., Kulkarni, S., Pasricha, P., Lee, G., Pomper, M., Dawson, V., Dawson, T. and Ko, H. (2019). Transneuronal Propagation of Pathologicα-Synuclein from the Gut to the Brain Models Parkinson’s Disease.Neuron, 103(4), pp.627-641.e7Liu, X., Wang, Y., Lu, H. et al. Genome-wide analysisidentifies NR4A1 as a key mediator of T cell dysfunction. Nature 567, 525–529 (2019) doi:10.1038/s41586-019-0979-8
19.Liu, A. (2019).CRISPR edits out a deadly lung disease in mice before birth. [online] FierceBiotech. Available at: https://www.fiercebiotech.com/research/crispr-editing-out-a-deadly-lung-disease-before-birth [Accessed 22 Dec. 2020].
20.Pan, Y., Yang, J., Luan, X., Liu, X., Li, X., Yang, J., Huang, T., Sun, L., Wang, Y., Lin, Y. and Song, Y. (2019). Near-infrared upconversion–activated CRISPR-Cas9 system: A remote-controlled gene editing platform.Science Advances, 5(4), p.eaav7199.
21.Prosser, M. (2019).Inside China's Play to Become the World’s CRISPR Superpower. [online] Singularity Hub. Available at: https://singularityhub.com/2019/08/18/inside-chinas-play-to-become-the-worlds-crispr-superpower/ [Accessed 2 Jan. 2020].
22.Sangjune Kim, Seung-Hwan Kwon, et al.Transneuronal Propagation of Pathologicα-Synuclein from the Gut to the Brain Models Parkinson’s Disease[J]. Neuron, 2019; DOI: 10.1016/j.neuron.2019.05.035
23.Silva, D., Yu, S., Ulge, U.Y. et al. De novo design of potent and selective mimics of IL-2 and IL-15. Nature 565, 186–191 (2019) doi:10.1038/s41586-018-0830-7
24.Tian, X., Gu, T., Patel, S., Bode, A., Lee, M. and Dong, Z. (2019). CRISPR/Cas9–An evolving biological tool kit for cancer biology and oncology.npj Precision Oncology, 3(1).
25.Velasco, S., Kedaigle, A., Simmons, S., Nash, A., Rocha, M., Quadrato, G., Paulsen, B., Nguyen, L., Adiconis, X., Regev, A., Levin, J. and Arlotta, P. (2019). Individual brain organoids reproducibly form cell diversity of the human cerebral cortex.Nature, 570(7762), pp.523-527.
26.Wetterstrand, K. (2019).DNA Sequencing Costs: Data from the NHGRI Genome Sequencing Program (GSP). [online] Genome.gov. Available at: https://www.genome.gov/about-genomics/fact-sheets/DNA-Sequencing-Costs-Data [Accessed 3 Jan. 2020].
27.Matthew B. Dong, et al.Systematic Immunotherapy Target Discovery Using Genome-Scale In Vivo CRISPR Screens in CD8 T Cells, Cell (2019). DOI:10.1016/j.cell.2019.07.044
28.Nurnberg.com.cn. (2014).胡安•恩里克斯和斯蒂文•迦兰斯. [online] Available at: _show.aspx?id=4511&author_id=0 https://www.ted.com/talks/juan_enriquez_the_age_of_genetic_wonder_nov_2019/transcript?language=zh-cn [Accessed 30 Dec. 2020].Velasco, S., Kedaigle, A.J., Simmons, S.K. et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex. Nature 570, 523–527 (2019) doi:10.1038/s41586-019-1289-x
29.Paper.people.com.cn. (2020).《科学》杂志权衡2020年十大科学头条. [online] Available at: -01/04/nw.D110000renmrb_20200104_10-03.htm [Accessed 2 Jan. 2020].
30.Prosser, M. (2020).Inside China's Play to Become the World’s CRISPR Superpower. [online] Singularity Hub. Available at: https://singularityhub.com/2019/08/18/inside-chinas-play-to-become-the-worlds-crispr-superpower/ [Accessed 31 Dec. 2020].
31.Tian, X., Gu, T., Patel, S., Bode, A., Lee, M. and Dong, Z. (2019). CRISPR/Cas9–An evolving biological tool kit for cancer biology and oncology.npj Precision Oncology, 3(1).
32.Zhou, C., Sun, Y., Yan, R. et al. Off-target RNA mutation induced by DNA base editing and its elimination by mutagenesis. Nature 571, 275–278 (2019) doi:10.1038/s41586-019-1314-0
33. 基因谷(2018).基因周报—2020年前全基因组测序价降至三百好意思元以内. [online] Sohu.com. Available at: _733985 [Accessed 3 Jan. 2020].